
الکترونگاتیوی به معنای تمایل یک اتم و یا یک گروه عاملی به جذب الکترون یا توده ای از بار منفی است.
همان طور که می دانید بار هسته مثبت است و توده ای از پروتون ها درون یک هسته ی بسیار کوچک قرار دارند. حال تصور کنید که چگونه این انبوه بار های مثبت می تواند بر الکترون های خود اتم اثر بگذارد. مسلماً هرچه لایه هایی که در آن ها الکترون قرار دارد نزدیک تر به هسته باشند، جاذبه ی بار مثبت افزایش می یابد و سخت تر می توان آن ها را جدا کرد.
با توجه به عبارت بالا می توان متوجه شد که هرچقدر شعاع یک اتم کوچکتر باشد، هسته به آخرین لایه ی اتم نزدیک تر است. همچنین این هسته می تواند الکترون های لایه ظرفیت اتم های اطراف را نیز به سمت خودش بکشد.
بنابراین می توان اینگونه نتیجه گرفت که در جدول تناوبی هرچقدر از چپ به راست حرکت کنیم، با توجه افزایش عدد اتمی و ثابت ماندن تعداد لایه های اصلی الکترون، جاذبه ی هسته نیز بیشتر می شود و الکترونگاتیوی افزایش می یابد اما در روند از بالا به پایین، به دلیل افزایش لایه های اصلی الکترونی و دور شدن لایه ظرفیت الکترون ها از هسته، الکترونگاتیوی کاهش می یابد.
اما نکته ی مهم دیگری که باید به آن توجه داشت این است که اساساً الکترونگاتیوی گازهای نجیب را هرگز اندازه نمی گیریم و تاکنون روش دقیقی برای اندازه گیری این مقدار در گازهای نجیب کشف نشده است. به همین خاطر است که F که یک هالوژن هم هست، بیشترین میزان الکترونگاتیوی را دارد.
حالا که با الکترونگاتیوی آشنا شدیم، کمی هم با پیوند کووالانسی آشنا شویم و بعد ارتباط میان این دو را بررسی کنیم:
پیوند کووالانسی پیوندی شیمیایی است که حاصل به اشتراک گذاشتن الکترون های میان دو اتم به وجود می آید. تفاوت اصلی آن با پیوند یونی این است که در پیوند یونی الکترون از اتمی به اتم دیگر منتقل می شود اما در اینجا الکترون هر اتم هم زمان که در مدار اتم خودش می چرخد، در مدار اتم دوم نیز گردش می کند.
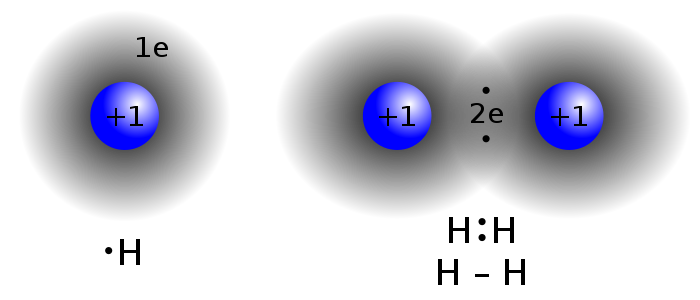 پیوند کووالانسی میان دو اتم هیدروژن
پیوند کووالانسی میان دو اتم هیدروژنهمانطور که می بینید در پیوند میان دو اتم هیدروژن، هر اتم یک الکترون را به اشتراک گذاشته اند و به این ترتیب هر کدام از هیدروژن ها لایه ظرفیت خود را تکمیل کرده اند.
اما مفهوم اصلی و بنیادی پیوند کووالانسی، الکترون و به اشتراک گذاشتن آن است. مسلم است که هرچقدر الکترونگاتیوی اتم مقابل بیشتر باشد، الکترون لایه ظرفیت اتم ما را بیشتر به سمت خودش می کشد و این حاصل از اختلاف الکترونگاتیوی میان دو اتم است.
اگر این اختلاف بیشتر از 1.7 باشد، پیوند یونی خواهد شد یعنی آنقدر الکترونگاتیوی یکی از اتم ها بالا بوده که توانسته الکترون را از مدار اتم دیگر خارج کند و در مدار خود جای دهد.
اگر این اختلاف کمتر از 1.7 باشد، پیوند ما از نوع کووالانسی خواهد بود و بدین ترتیب اتم ها الکترون را میان خود به اشتراک می گذارند. به عنوان مثال در تصویر بالا چون دو اتم یکسان داریم (هر دو هیدروژن هستند)، اختلاف الکترونگاتیوی میان آن ها صفر خواهد بود و دو اتم به یک میزان از الکترون های به اشتراک گذاشته شده سهم خواهند برد.
اما ممکن است که همیشه دو اتمی که با یکدیگر پیوند کووالانسی می دهند یکسان نباشند. به عنوان مثال تصور کنید که اکسیژن و هیدروژن می خواهند با یکدیگر پیوند کووالانسی دهند.
در این پیوند الکترونگاتیوی اکسیژن بسیار بالاتر از الکترونگاتیوی هیدروژن است. به همین خاطر اکسیژن سهم بیشتری را از الکترون های به اشتراک گذاشته شده به سمت خودش می کشد. اما این اختلاف آن قدر زیاد نیست که اکسیژن بتواند تمامی الکترون را درون مدار خود قرار دهد. بنابراین الکترون به صورت ابری در می آید که این ابر بیشتر در سمت اکسیژن سایه می اندازد تا در سمت هیدروژن و به همین خاطر می گوییم که اکسیژن توانسته است جزئی بار منفی را به سمت خود بکشد و هیدروژن که سهم کمتری از الکترون را دارد، جزئی از بار مثبت را به سمت خود کشیده است.






